继ITM采样器获得FDA 510K认证后

耐思VTM采样器也喜提认证!

"510K 是什么?"
510K是FDA法规里面的一个章节,因其相应FD&C Act第510章节,故通常称510K注册,是Pre Market Notification 上市前通告。510K是医疗器械在美国上市的主要途径之一,绝大多数的II类医疗器械和部分I类、III类医疗器械通过此途径清关上市。
"有哪些企业的VTM采样器通过了FDA认证?"
在符合相关政策与规定的要求下,
共有82家制造商正在生产与销售新冠核酸采样器!

"为什么耐思要开发多种类型的采样器?"
针对新冠的检测形式与保存要求的多样化,耐思以多种采样拭子与保存液规格,以满足各式采样需求。
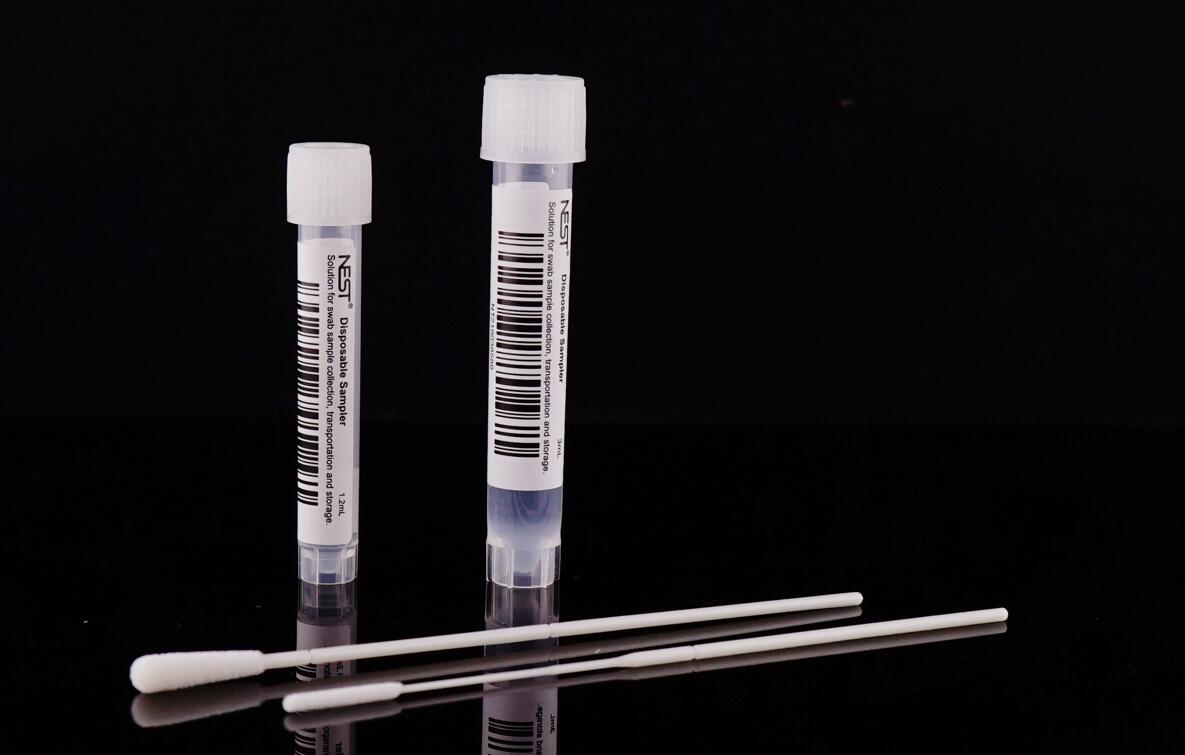
五种采样拭子

VTM 非灭活溶液
-
用于收集、储存和运输人鼻咽病毒样本
-
未使用的VTM溶液可在室温下运输
- 样品可储存时间及温度要求:2~4℃, 48小时
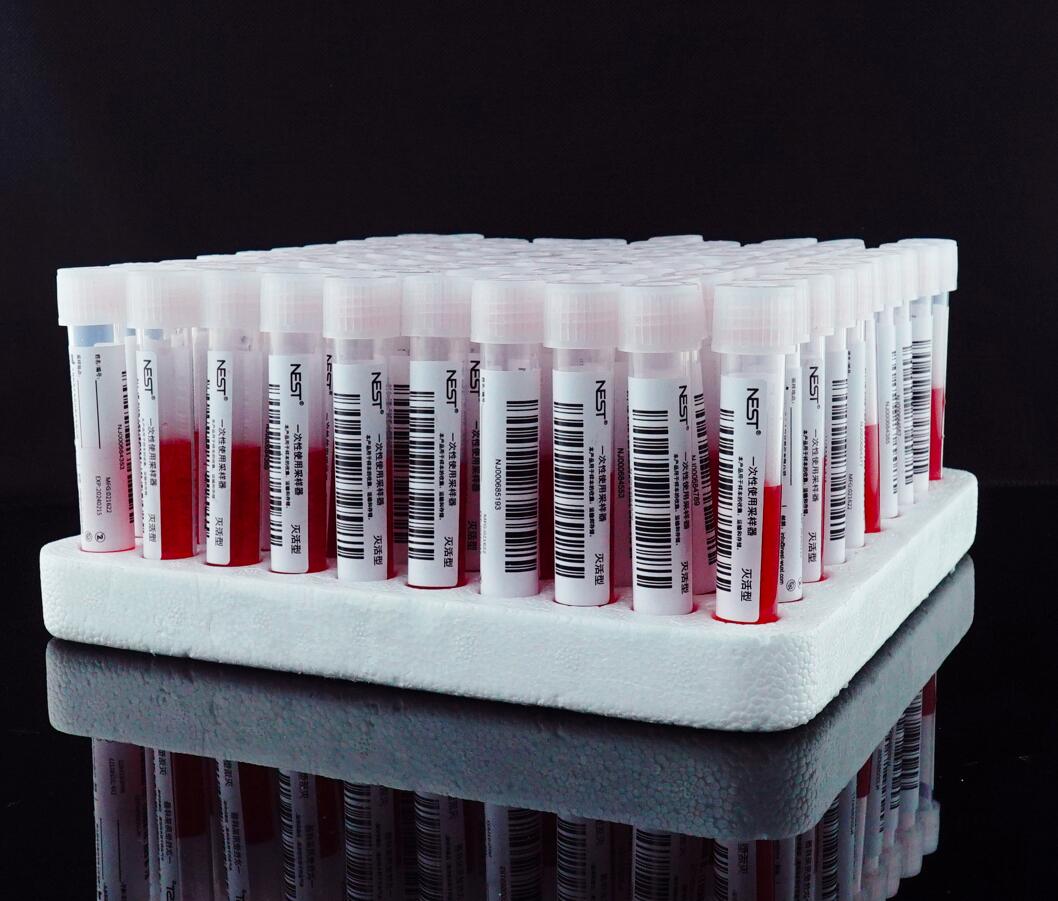
十合一混采
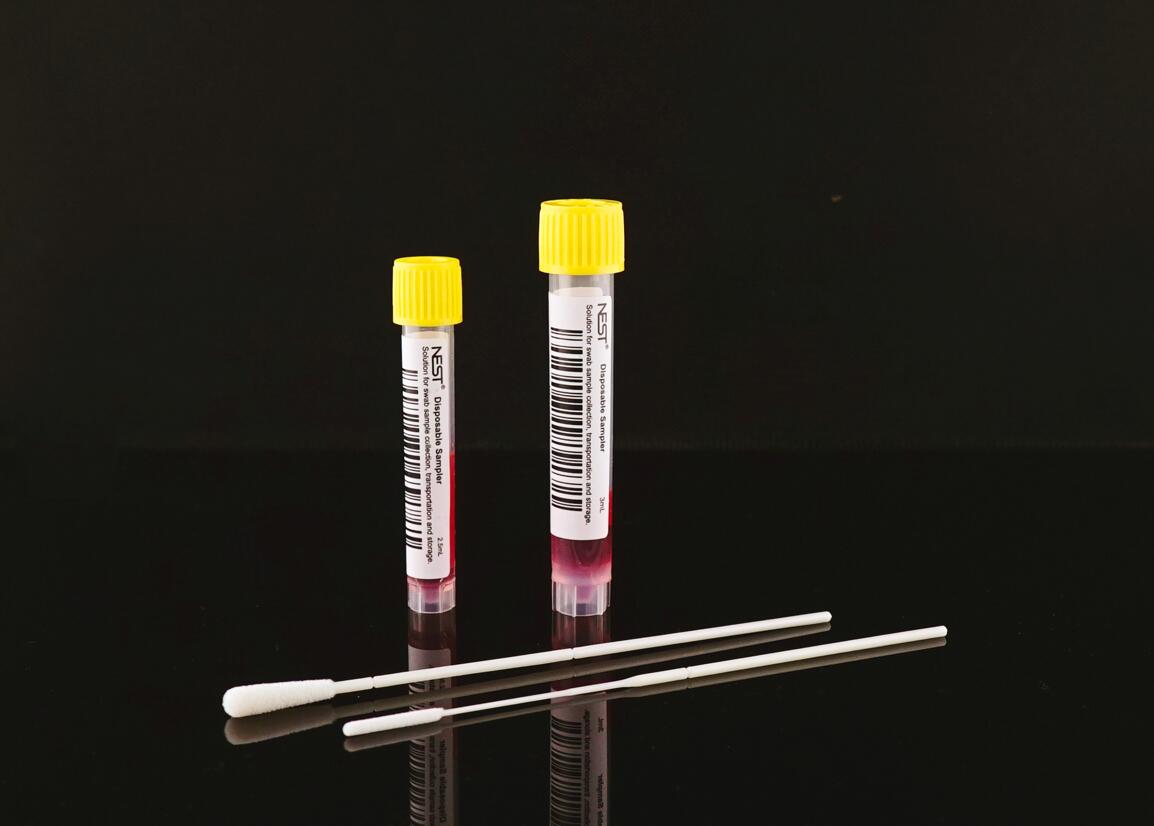
ITM 灭活溶液
-
溶液具有灭活病毒和防止核酸降解的作用
-
可常温运输 ,样品溶液采样后可保存 20 天
-
用于病毒、衣原体、支原体、脲原体的收集、贮存和运输。
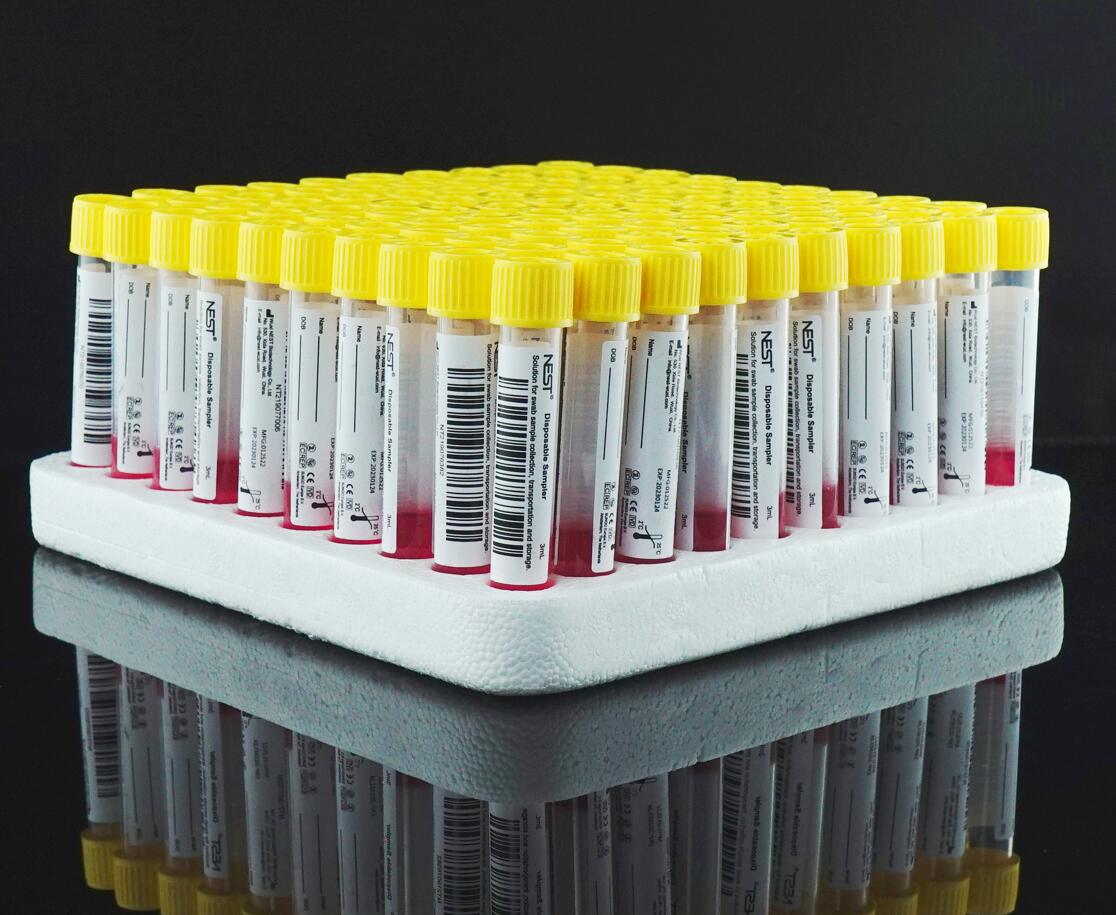
十合一混采