口腔鳞状细胞癌 (OSCC) 是最常见的口腔恶性肿瘤,转移是导致 OSCC 预后不良的原因。自噬被认为通过缓解各种细胞压力来促进 OSCC 的发展。然而,自噬在 OSCC 细胞增殖和转移中的机制尚不清楚。
近日,上海交通大学、浙江大学和陆军军医大学的研究团队合作在Signal Transduction and Targeted Therapy(中科院JCR一区,IF:18.187 )上发表了题为“NUPR1 promotes the proliferation and metastasis of oral squamous cell carcinoma cells by activating TFE3-dependent autophagy”的研究论文。研究者通过对福尔马林固定石蜡包埋(FFPE)肿瘤样本的蛋白质组进行检测,发现了一个在淋巴结转移组中显著上调的蛋白——NUPR1,并通过实验明确NUPR1-TFE3轴通过自噬途径促进 OSCC 细胞增殖和体内外转移的机制。本研究可能为 OSCC 的治疗提供潜在的治疗靶点。
研究思路

1. FFPE蛋白质组学发现NUPR1在有淋巴结转移的OSCC中显著上调
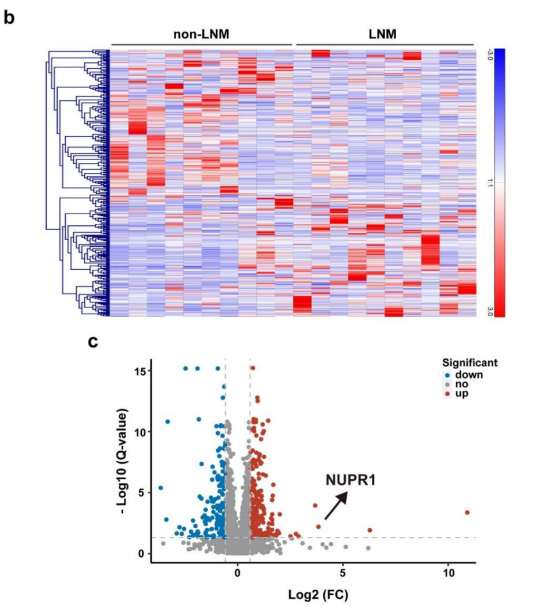
作者对10个有淋巴结转移(LNM)和10个无淋巴结转移的口腔鳞状上皮细胞癌组织FFPE样本进行了蛋白质组学检测,共定量了3021个蛋白。有淋巴结转移比无淋巴结转移分析得到208个上调蛋白和165个下调蛋白。其中NUPR1蛋白在有淋巴结转移组中的表达显著高于无淋巴结转移组,是上调倍数前五的蛋白。
2. NUPR1与患者的OSCC进展和不良预后呈正相关
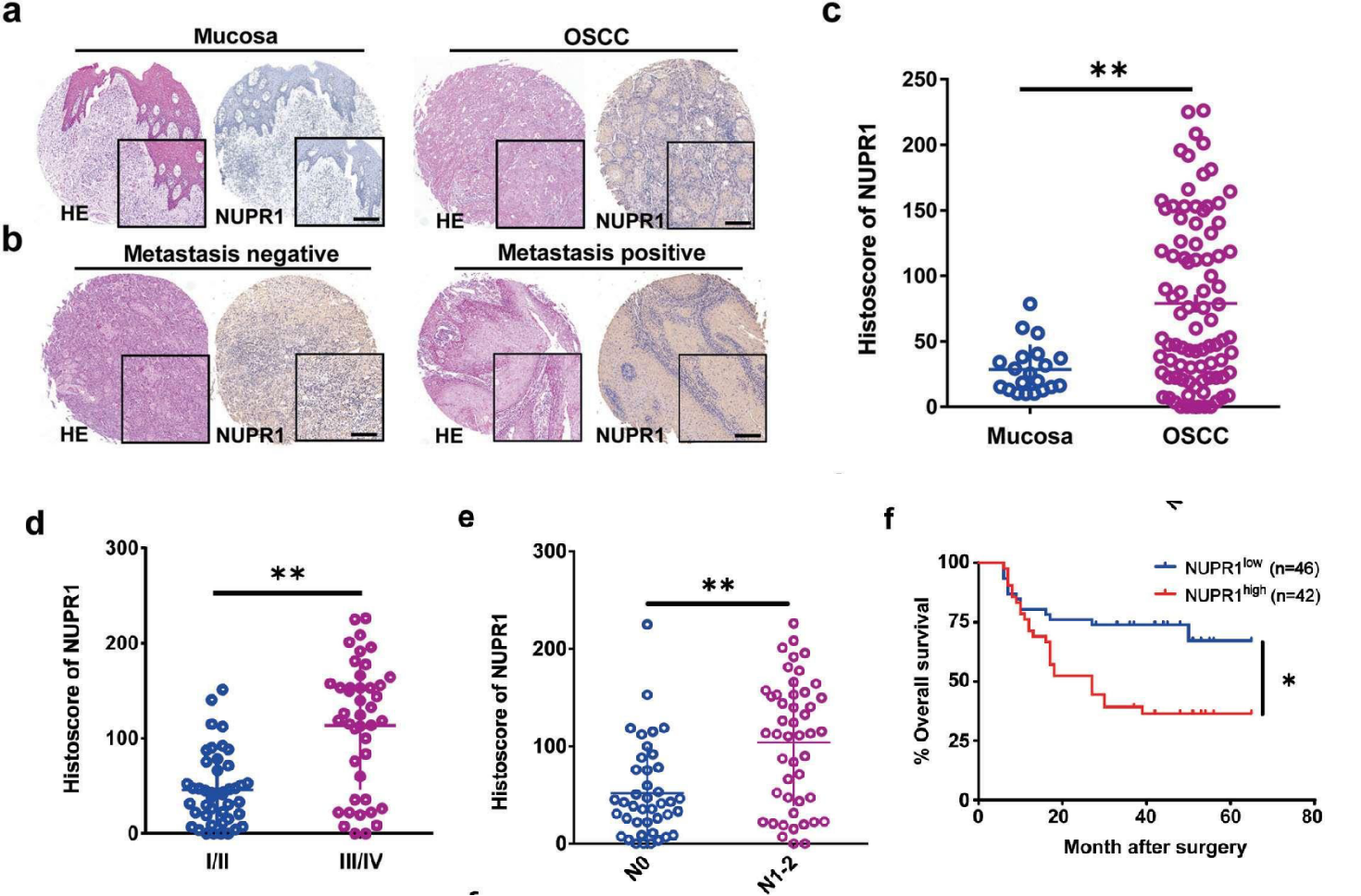
研究者使用免疫组化染色(IHC)进行了NUPR1的组织芯片(TMA)实验(OSCC组织88个,正常口腔黏膜组织20个)。结果显示,NUPR1在OSCC组织中显著高表达。临床相关性分析显示,高表达NUPR1与OSCC TNM分期和淋巴结转移正相关。KM分析表明,高表达NUPR1的患者有更低的总生存率,即高表达NUPR1意味着不良的预后。
3. NUPR1基因敲低(KD)抑制了OSCC的进展
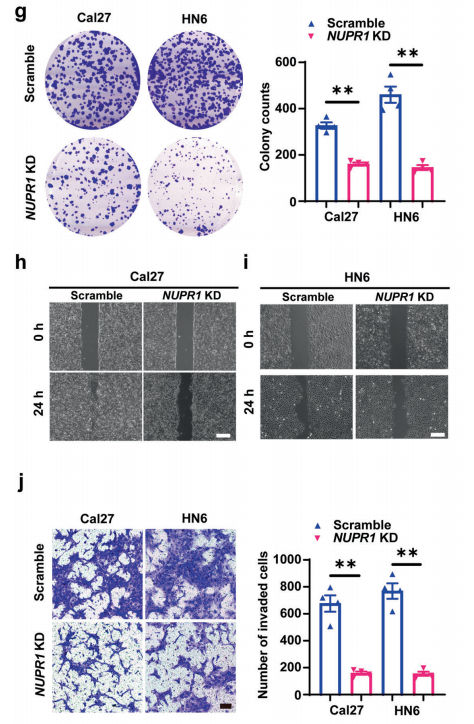
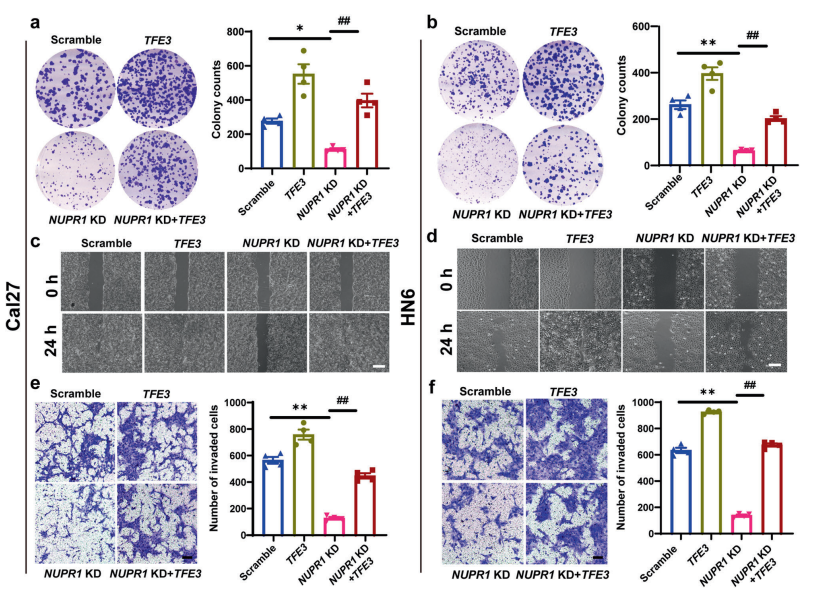
为了明确NUPR1在OSCC进展中的作用,作者在高表达NUPR1的Cal27和HN6 癌细胞系中对NUPR1进行敲低(NUPR1 KD)。集落形成实验显示,NUPR1 KD显著降低了癌细胞的集落形成效率。此外,伤口愈合和Transwell检测显示,NUPR1 KD 的OSCC细胞迁移和侵袭能力明显受到抑制。总体而言,NUPR1 敲低有效地抑制了OSCC的进展。
4. 蛋白质组学揭示自噬在NUPR1介导的OSCC进展过程中起着关键作用
为了阐明NUPR1在OSCC进展中的潜在机制,研究者通过TMT定量蛋白质组学检测了NUPR1敲低的Cal27细胞和对照细胞之间的蛋白谱变化(3vs.3)。与对照组相比,NUPR1敲低的OSCC组中27个蛋白显著上调,28个蛋白显著下调。KEGG富集显示,NUPR1敲低组的自噬通路显著富集。该结果表明,自噬可能在NUPR1介导的OSCC进展中发挥重要作用。
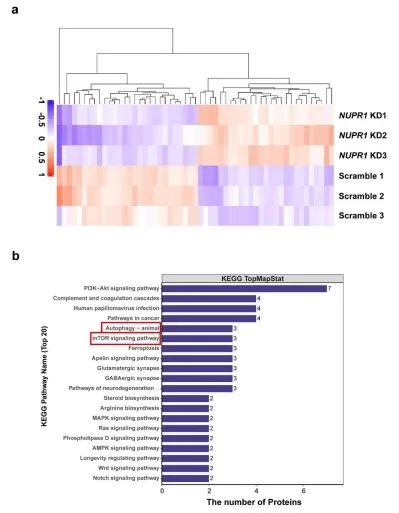
5. NUPR1 敲低阻断了OSCC细胞中的自噬流
接下来,研究者进一步探索了NUPR1敲低是否影响OSCC细胞的自噬流(autophagic flux)。MAP1LC3B-I是一个公认的自噬标记,通常驻留在细胞质,但在诱导自噬时,它会被脂化并嵌入自噬体膜(形成MAP1LC3B-II 异构体)。免疫印迹分析显示NUPR1敲低增加MAP1LC3B-II的蛋白表达水平。此外,在Cal27和HN6细胞中也检测到SQSTM1的明显升高。自噬涉及多个步骤,自噬小体的积累可能是由于自噬活性上调或自噬小体周转减少所致。NUPR1敲低导致MAP1LC3B-II和SQSTM1的表达增加,这似乎意味着NUPR1 敲低损害了OSCC细胞的自噬流。氯喹(CQ)抑制溶酶体活性,干扰自噬体和溶酶体之间的融合,抑制自噬。然而,NUPR1敲低诱导的MAP1LC3B-II表达的增加不受CQ共处理的影响。这些结果表明,NUPR1敲低抑制了OSCC细胞的自噬流。
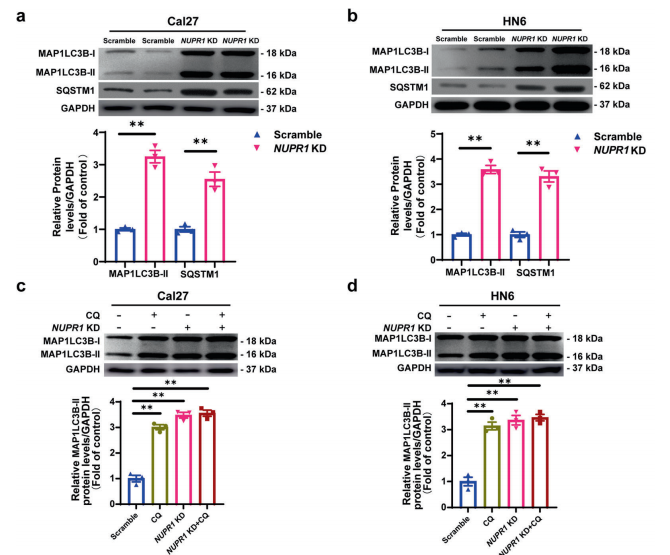
由于自噬是一个动态的再循环系统,具有多步骤的过程,研究者进一步研究了NUPR1敲低在早期或晚期诱导的自噬抑制作用。最终结果表明,NUPR1 敲低并不能影响OSCC细胞中自噬小体的形成或成熟。
7. NUPR1敲低对OSCC细胞中的自噬体-溶酶体融合无影响
自噬小体与溶酶体的融合是自噬降解的一个基本过程。研究者通过实验发现,在Cal27和HN6细胞中,自噬体标记物GFP-LC3和溶酶体标记物LAMP2之间的共定位比例不受NUPR1敲低的影响。
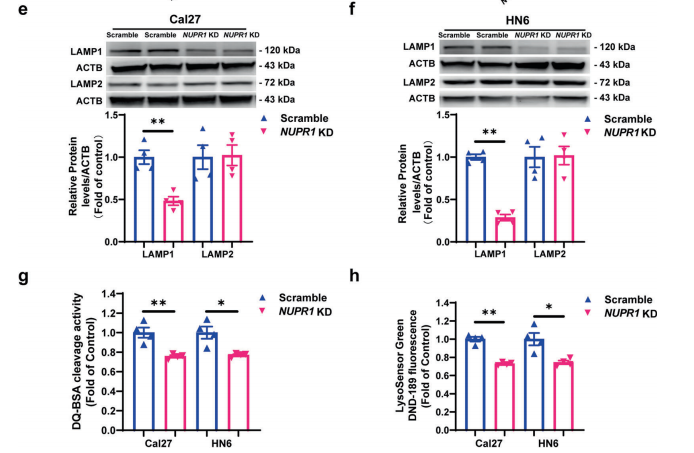
8. NUPR1敲低抑制了OSCC细胞中溶酶体的功能
为了研究NUPR1敲低是否抑制溶酶体功能,研究者检测了位于溶酶体膜表面的溶酶体标记物LAMP1和LAMP2的表达水平。结果表明,NUPR1敲低抑制了Cal27和HN6细胞中LAMP1的表达,但没有抑制LAMP2的表达。在NUPR1敲低的OSCC细胞中,溶酶体蛋白水解活性明显被抑制。因此,NUPR1敲低对自噬流的损害可能是通过抑制OSCC细胞中的溶酶体功能来介导的。
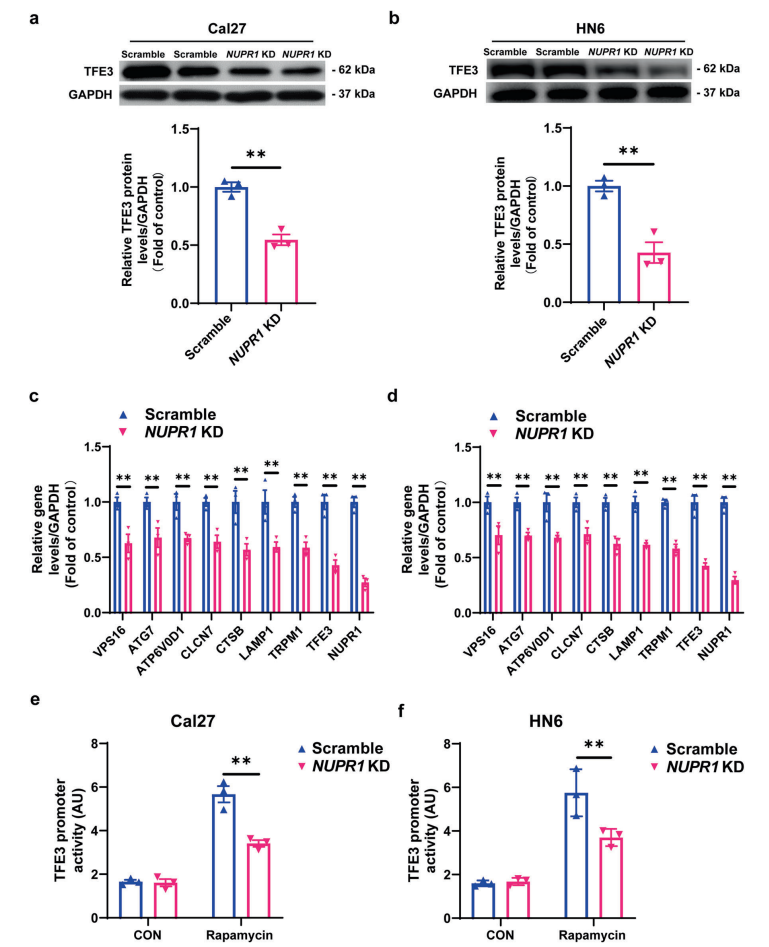
9. TFE3负责OSCC细胞中NUPR1介导的自噬溶酶体过程
为了阐明NUPR1介导的自噬-溶酶体加工的潜在机制,研究者分析了NUPR1敲低的Cal27细胞与对照细胞之间的差异蛋白。NUPR1敲低OSCC细胞中,TFE3显著下调。研究者同时用PCR证实了自噬流中涉及的“TFE3应答基因”的表达变化,提示NUPR1在自噬溶酶体事件中发挥了关键作用,并可能与TFE3有关。
最近,NUPR1被报道为调控基因转录的重要转录因子。因此,研究者采用荧光素酶报告基因实验来检测NUPR1和TFE3之间的关系。结果表明,在自噬激动剂雷帕霉素(0.1μM)处理24h的OSCC细胞中,TFE3启动子活性明显增加,但与对照组相比,在NUPR1敲低的OSCC细胞中明显被抑制。综上所述,在OSCC进展过程中,NUPR1通过增加TFE3启动子活性和激活TFE3转录来维持自噬流。此外,研究者在OSCC组织中检测了TFE3,发现NUPR1与TFE3的表达呈正相关。过表达TFE3可以显著挽救NUPR1敲低对Cal27和HN6细胞溶酶体功能的损伤。此外,在NUPR1缺失的OSCC细胞中,TFE3过表达也显著降低了MAP1LC3B-II和SQSTM1的积累。
10. NUPR1通过激活TFE3依赖的自噬促进OSCC的进展
最后,研究者对TFE3进行过表达,观察NUPR1敲低OSCC细胞进展能力的变化。结果表明,TFE3过表达部分逆转了NUPR1敲低介导的OSCC细胞迁移和侵袭的抑制作用。
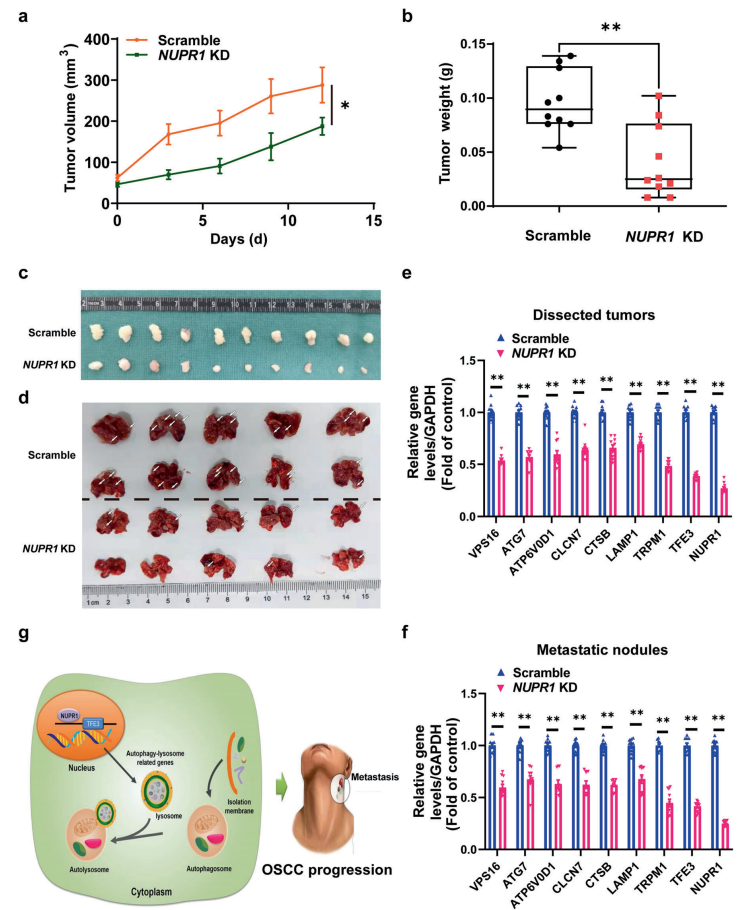
此外,研究者还发现NUPR1敲低导致接种于裸鼠皮下的Cal27细胞形成的肿瘤的体积和重量明显减少。NUPR1敲低也抑制了转移性结节的形成和生长。同时,NUPR1敲低有效地抑制了异种移植瘤模型中TFE3和“TFE3应答基因”的表达。在对转移性结节的评估中也得到了同样的结果。总之,这些发现表明,NUPR1敲低对OSCC进展的抑制依赖于TFE3活性的抑制。
研究者对有淋巴结转移和无淋巴结转移的口腔鳞状细胞癌 (OSCC)组织FFPE样本进行了基于质谱的蛋白质组学检测。NUPR1被确定为在有淋巴结转移的患者中显著高表达的关键蛋白,并与OSCC转移和不良预后呈正相关。NUPR1敲低能显著OSCC细胞系的增殖和转移。后续机制实验进一步确定NUPR1敲低诱导癌细胞自噬流损伤,且是通过影响溶酶体功能障碍而非其他关键的自噬步骤。最后,研究者进一步确认,在OSCC进展过程中,NUPR1通过增加TFE3启动子活性和激活TFE3转录来维持自噬流。因此,本研究拓宽了关于NUPR1-TFE3依赖的自噬在OSCC进展中的潜在治疗靶点的新见解。
近2年的蛋白质组学文献的思路以及本期分享的科研思路仍主要以“新基因,新机制”为主。吉凯基因整理出的以蛋白质组学为核心的科研思路如下所示,希望可以助力各位老师临床科研更轻松。完整的组学研究三部曲请联系吉凯当地销售工程师咨询!
吉凯基因凭借多年在靶标筛选及验证服务领域的技术积累,建立的标准化 、工程化 、系统化的GRP平台,为中国研究型医生提供科研服务,加快科研成果转化。其中,多组学平台包含蛋白质组学平台和高通量测序平台:
·蛋白质组学平台拥有多台timsTOF Pro、Exploris 480高精度质谱仪,专业的Spectronaut Plusar、Mascot等分析软件,提供专业的4D、DIA、TMT、PRM、磷酸化修饰组、Olink蛋白质组等检测服务,强大的机器学习算法、IPA分析、蛋白基因组分析服务,系统的生物标志物、分子分型、药物靶点、基因功能研究等解决方案,真正让广大研究型医生的科研工作更省心、更省力、更高效;
·高通量测序平台分为常规测序服务和单细胞测序服务:单细胞测序拥有10x和BD两个平台,提供单细胞RNA-seq、单细胞核测序、单细胞混样RNA-seq、单细胞TCR/BCR、单细胞(RNA+ATAC)、空间转录组测序等服务;常规测序服务提供meRIP-seq(m6A/m1A/m7G/m5C 等RNA甲基化修饰测序)、acRIP-seq(ac4C RNA乙酰化修饰测序)、ATAC-seq、Ribo-seq(翻译组测序) 、mRNA/miRNA/LncRNA/circRNA-seq、全转录组测序(两文库/三文库)、外泌体miRNA/LncRNA-seq、WGS/WES、WGBS、RRBS、BSAS等服务。
