胃肠道内分泌细胞(EECs)通过受体传感器释放各种肽类激素,以靶向调控食物消化、营养同化、胰岛素释放等过程。EECs共有10多种亚型(图1),其功能障碍与多种疾病病因紧密关联,如胰高血糖素样肽-1(GLP-1)分泌受阻与糖尿病和肥胖的高发生相关。因此,EECs已成为代谢疾病的重要治疗靶点,亟需更健全的数据库及更深入的研究。
事实上,人体内EECs数量极其稀少,仅占肠上皮的约1%,且组织来源的EECs在未经固定的情况下难以识别并纯化,而小鼠等模式动物与人类之间又存在显著的种间差异。相较而言,来自于人原代组织,保留器官生理功能并具备结构相似性的类器官正在成为研究EECs功能的体外重点模型。
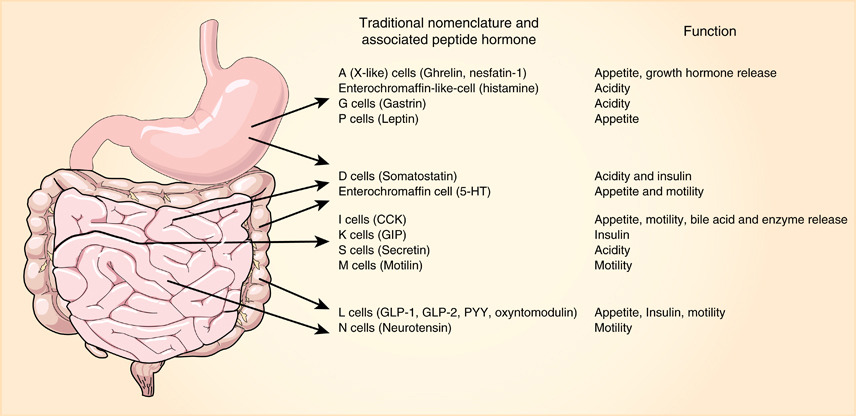
图1:胃肠道内分泌细胞的不同亚型
(来源:参考资料[1])
2020年,类器官之父Hans Clevers团队开发出肠道内分泌细胞的类器官平台,并据此绘制了EECs的转录组学与分泌产物表达图谱,为体外EECs功能的研究奠定了基础[2]。2024年10月23日,Hans Clevers教授再次联合罗氏制药团队,于顶刊Science发表了题为“Description and functional validation of human enteroendocrine cell sensors”的研究论文。本研究中,通过NEUROG3过表达诱导了胃类器官EECs文库的生成,并结合此前的肠道类器官EECs文库生成了深度受体转录组图谱。该类器官数据库与CD200筛选得到的组织EECs具有高度一致性,可作为体外可靠模型。研究团队随后在具有22个不同受体缺陷的类器官系中进行了配体诱导的分泌实验,揭示了调控GLP-1等激素分泌的多个受体传感器,为糖尿病等治疗提供了潜在的药理学靶点。

(来源:参考资料[3])
01 诱导胃类器官向内分泌谱系分化
长久以来,EECs一直难以在胃类器官中大量产生。在此,研究人员向其培养基中加入多西环素,诱导胃类器官过表达NEUROG3(一类在EECs祖细胞中共同表达的转录因子)两天,随后将类器官转移至含有EGF、Noggin和R-spondin的培养基中成熟。透射电子显微镜结果显示,类器官成功分化产生了EECs。
这些EECs可在 cAMP激动剂刺激下产生5-羟色胺(5-HT)和生长素释放肽,显示出成熟的分泌功能。蛋白质组学分析发现,仅在NEUROG3过表达的情况下,胃类器官产生积蓄于胞内以及运送出胞外的内分泌产物,且检出多种已知的全长并具有生物活性胃内分泌激素。在没有NEUROG3过表达的对照组中,胃类器官细胞倾向于构建黏液屏障执行保护胃肠道黏膜的正常生理功能,而非内分泌功能。
此外,加入类器官生长因子BMP还可诱导细胞胃动素MLN、神经肽NPW等激素的表达。而激素肽TAC3等仅在没有添加BMP的情况下富集。但不论BMP添加与否,ECL(肠嗜铬样细胞,胃体独特的EEC亚群)标志物均未检出。
总而言之,NEUROG3足以诱导除ECL外主要胃内分泌谱系的分化。BMP可在此基础上对分泌产物进行调控和修饰。
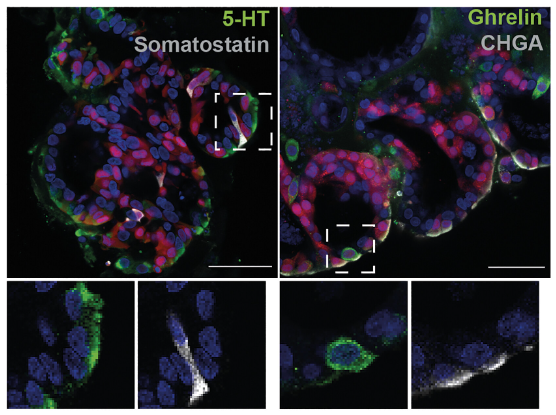
图2:富含EECs的类器官的免疫荧光染色
(来源:参考资料[3])
02 胃肠类器官EECs中的GPCR谱
与此前建立的肠道类器官文库结合,研究人员从胃肠道类器官整体文库中筛选得到EECs,bulk RNA-seq分析发现其激素表达谱与预期一致。
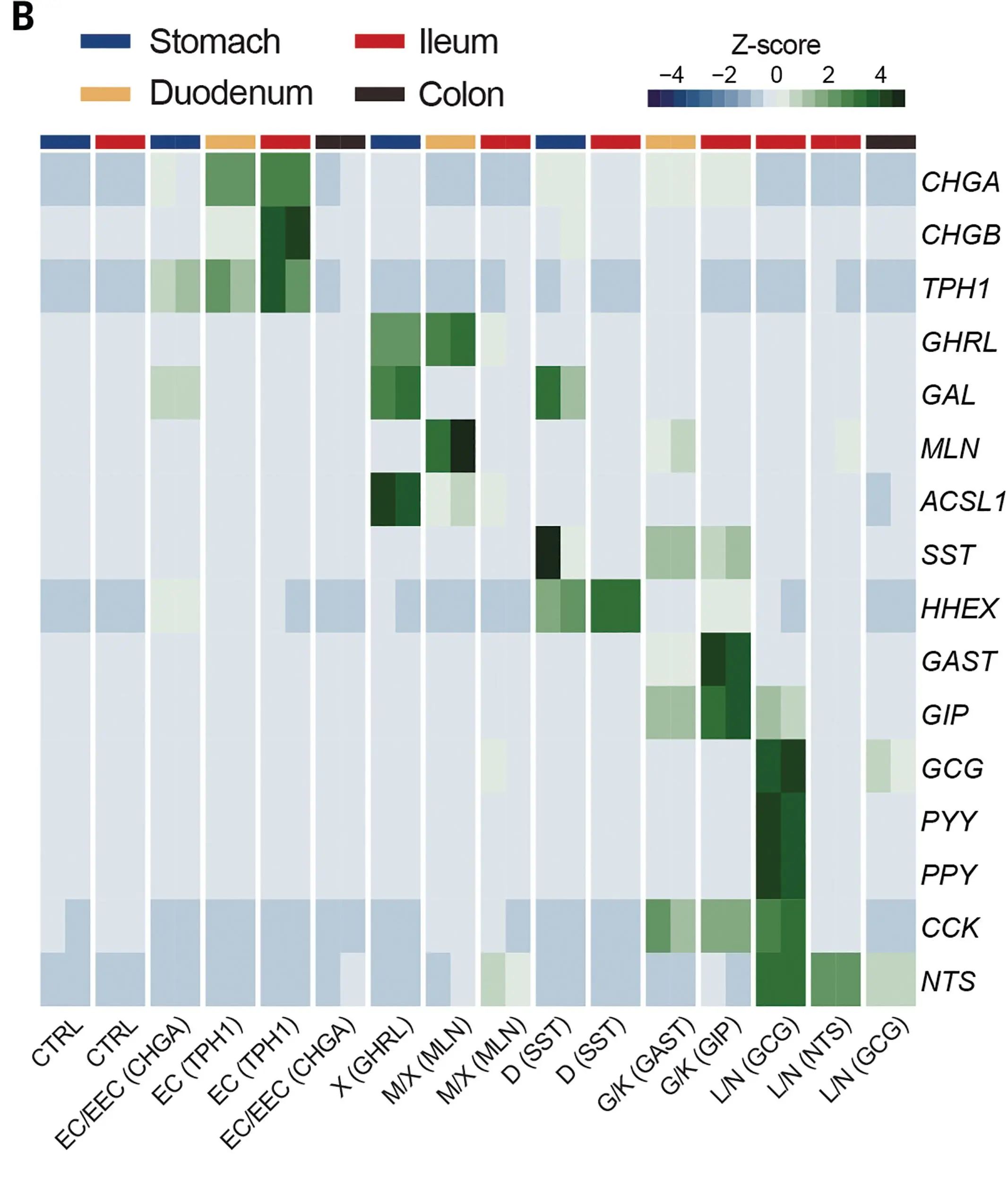
图3:EECs中激素表达谱热图
(来源:参考资料[3])
G蛋白偶联受体(GPCR)可通过与配体的结合响应胃肠道环境变化,进而调控EECs内的钙离子水平并控制激素分泌,是一类非常重要和典型的激素传感器。研究人员随后聚焦于以GPCR为代表的受体,发现在胃肠道类器官EECs中,除许多与此前报道相同的GPCR表达外,还发现了一些此前未知的EECs特异性受体基因,如黑寡妇毒素α-latroxin受体ADGRL1/2、多巴胺受体DRD2等。
有趣的是,研究人员还发现了部分受体的表达谱与此前报道不符,如据称可调控胰高血糖素样肽1(GLP-1)的黑皮质素受体MC4R在任何EECs中均无显著表达,而另一种黑色素皮质素受体MC1R则有少量检出。此外,小肠EC细胞的5-HT分泌主要通过营养受体胆汁酸受体GPBAR1调节,这也与过往结果有所出入。
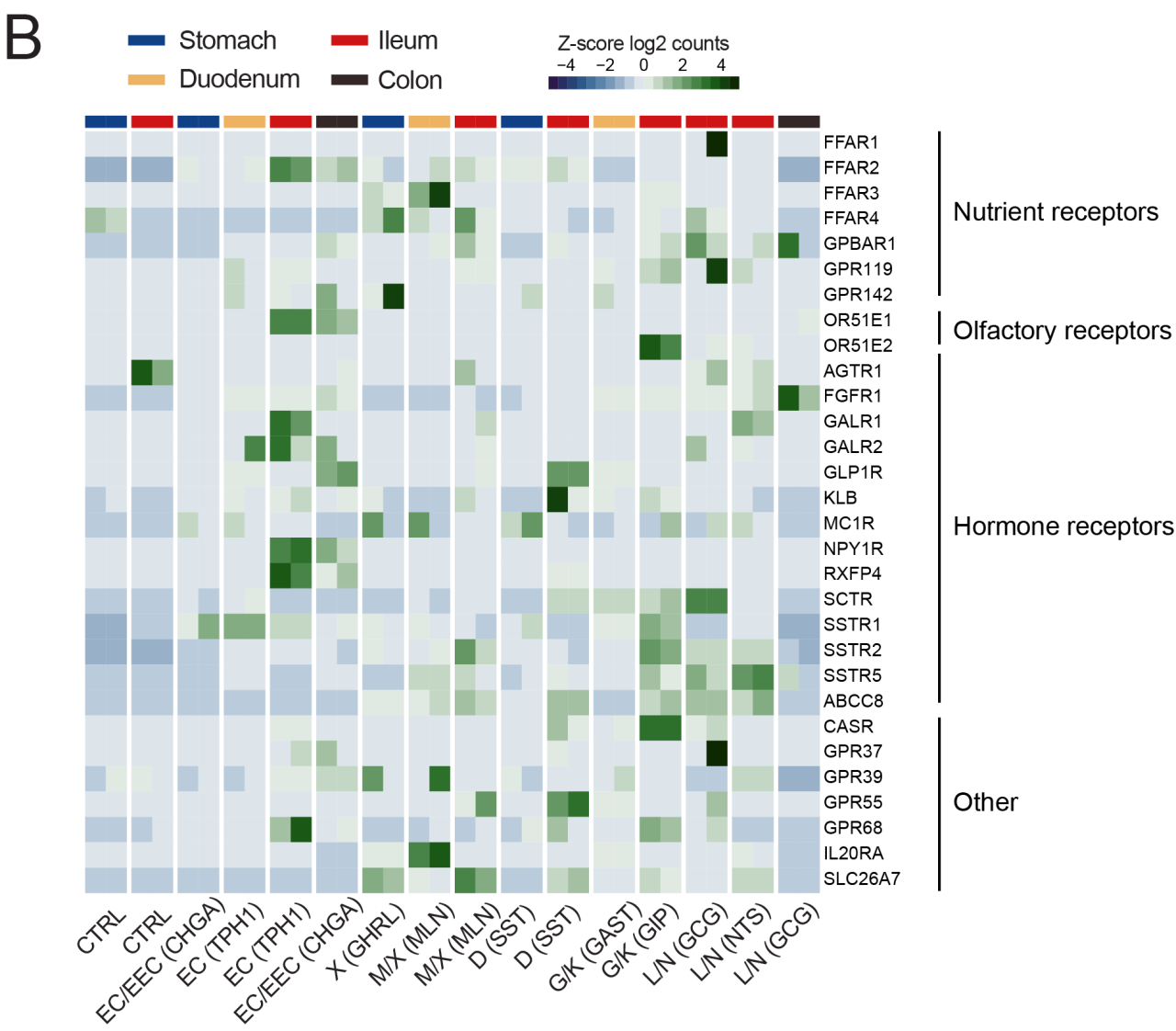
图4:类器官EECs中受体基因表达谱热图
(来源:参考资料[3])
03 类器官EECs与人原代EECs高度一致
研究人员随后从人胃、小肠和结肠活检组织中分选富含CD200(一类免疫调节剂,可作为EECs的一般表面标志物)和EPCAM的细胞并进行了scRNA-seq,获取了比以往更深度的人类EECs数据集。与类器官EECs表达谱一致的是,人类组织EECs中也检出了富集的α-latroxin受体与少量MC1R,且未检测到MC4R。
为探究胃类器官因何缘由无法产生ECL细胞,研究者对组织数据集中的ECL分化调节因子进行了研究,发现其中转录因子PTF1A及BRPJL和其靶基因LHX5特异性表达水平极高。PTF1A是胰腺发育中负责胰蛋白酶、淀粉酶等多种消化酶分泌的调控因子。在此,PTF1A过表达时,细胞向腺泡转分化,相应肽酶出现高表达,类器官大量凋亡,基质胶降解。此外,尽管LHX5与NEUROG3可组合可诱导ECL细胞关键标志物组氨酸脱羧酶(HDC)的表达,但其提升能力有限,HDC表达量依旧较低。这些结果表明,胃类器官无法通过此通路产生ECL。
总之,类器官与人类组织来源的人原代EECs之间具有高度一致性,并伴随有细微的表达区域特异性差异,可作为内分泌谱系(除ECL外)的体外可靠模型。
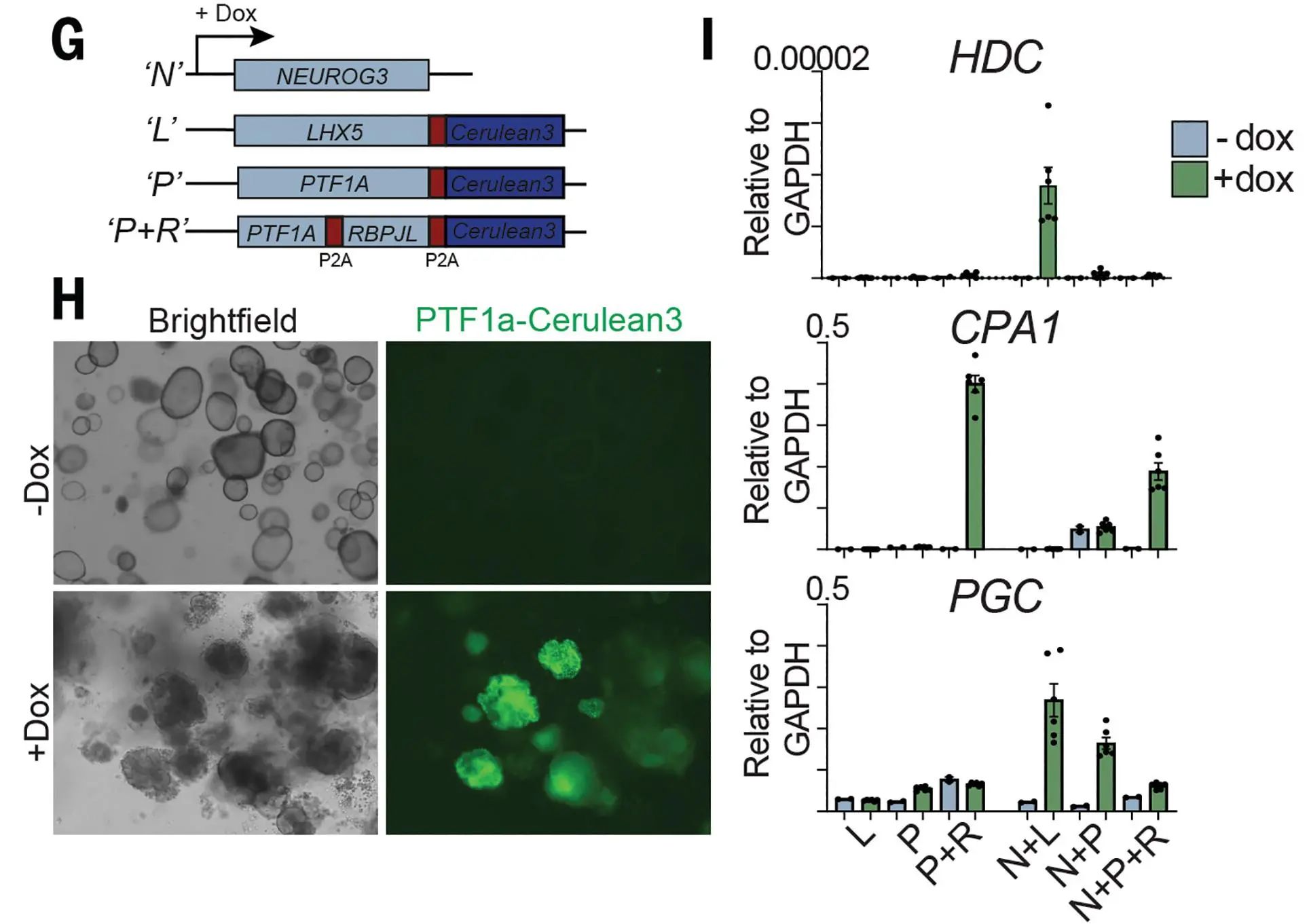
图5:类器官中LHX5和NEUROG3的组合诱导结果
(来源:参考资料[3])
04 利用类器官EECs进行受体功能研究
在证明类器官EECs可作为体外研究模型后,研究人员引入纯合无义突变并构建了22种受体缺陷的胃肠道类器官系。理论上,受体缺陷的类器官,其配体与受体结合并启动下游激素分泌的通路受阻。若阳性对照组与WT组检测到激素分泌,则提示该受体是对应激素的调控传感器。概念验证证明了胆汁酸受体GPBAR1对GLP-1和5-HT的诱导,这与此前的受体基因表达谱结果一致,也论证了此设计的可行性。
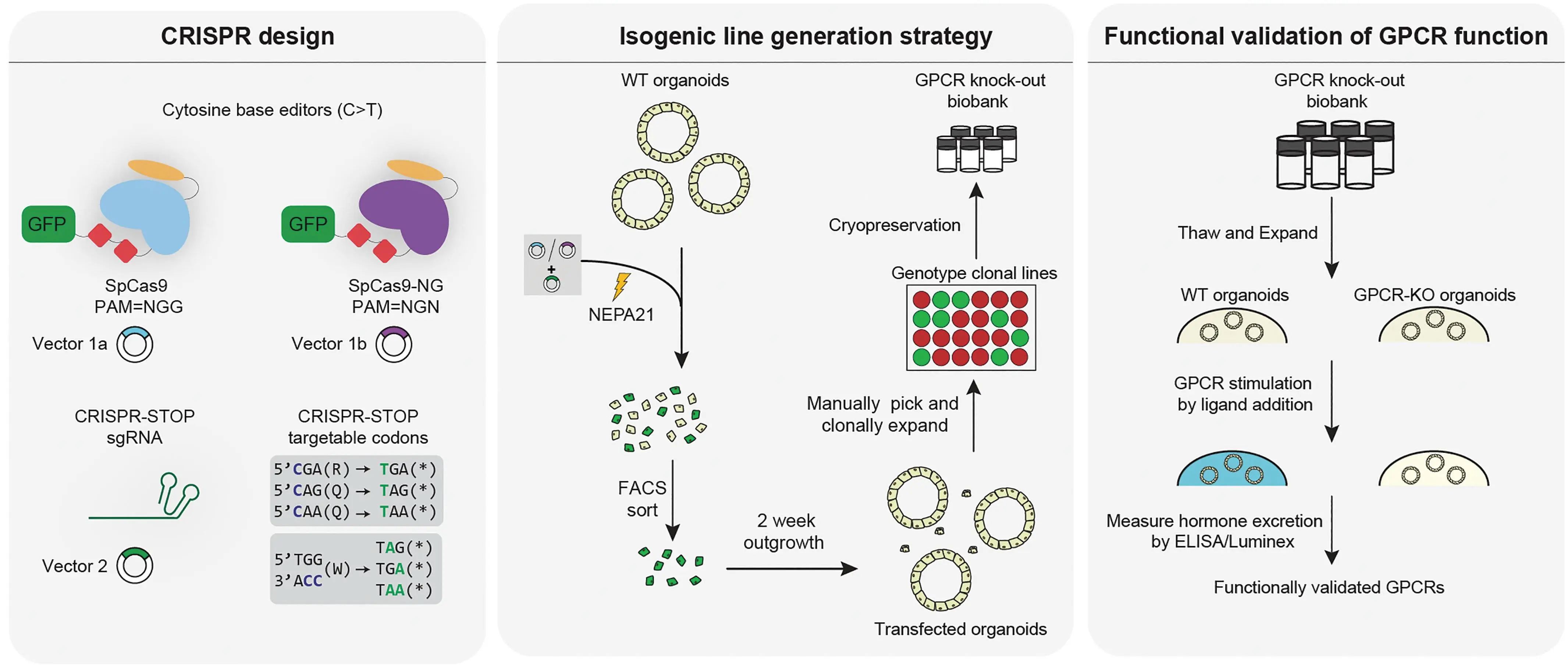
图6:受体功能研究实验管线
(来源:参考资料[3])
研究人员进而使用GPCR激动剂刺激了整个类器官文库,结果发现了所有肠道激素的有效释放。测试分泌16小时后上清液中激素的浓度,发现抑制磺酰脲受体基因ABCC8可控制ATP敏感性钾通道并据此调控GLP-1和5-HT的肠道分泌,且ABCC8基因突变与2型糖尿病相关。此外,色氨酸受体CasR也参与控制GLP-1分泌。而大量表达的多巴胺受体可抑制EC(肠嗜铬细胞,最主要的EEC亚型)中5-HT的分泌。该过程可通过几种已被批准的多巴胺受体抑制剂逆转,但不同抑制剂逆转效果各异,反映了不同多巴胺受体对5-HT分泌的不同抑制活性。
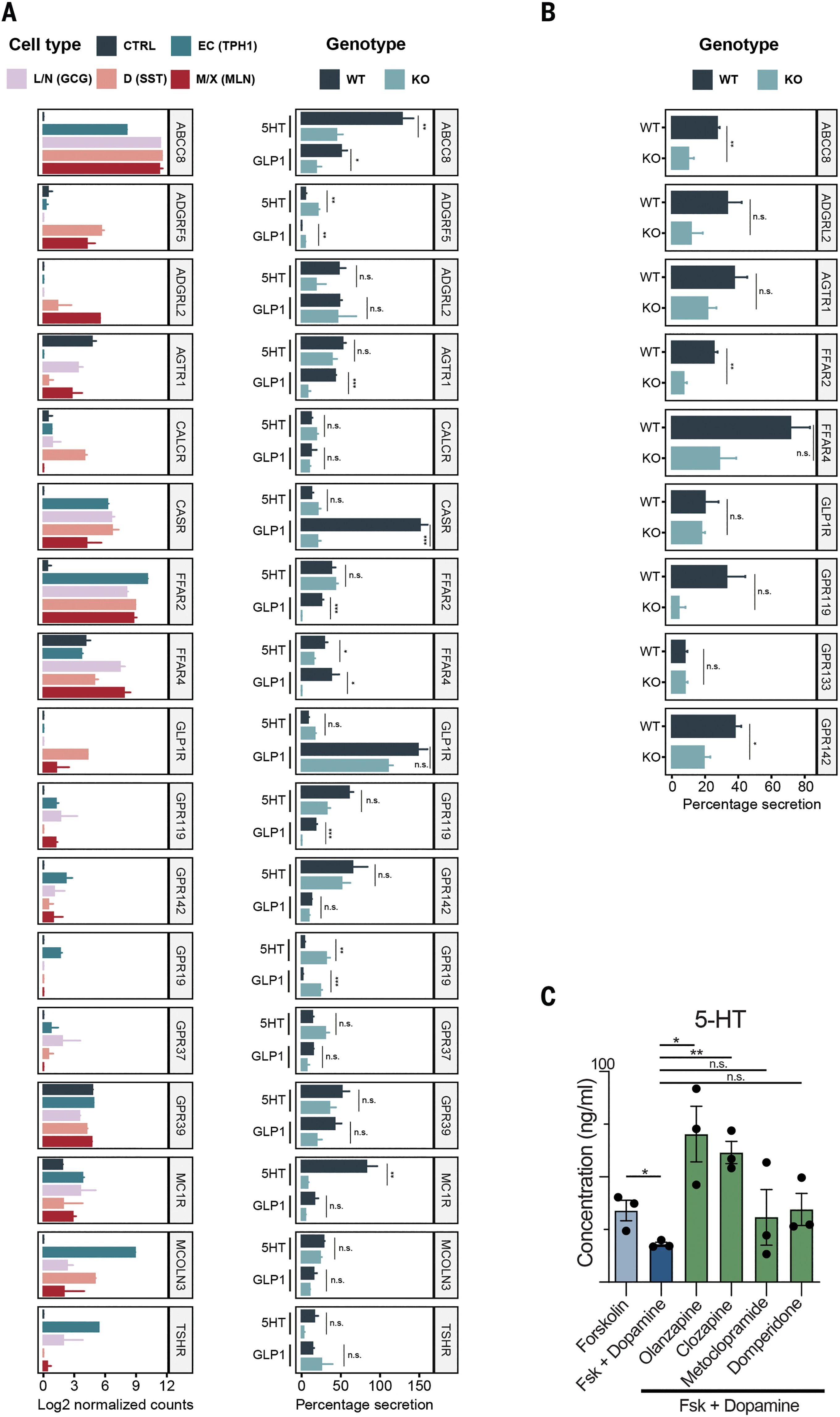
图7:受体缺陷型(KO)和野生型(WT)类器官的激素分泌测试
(来源:参考资料[3])
05 结论与展望
基于EECs的药物开发目前围绕着两条思路展开,即生成激素模拟物,或刺激EECs受体以控制多种激素产物的局部分泌。相关研究需要深度的EECs受体转录组数据集,与包含每种EECs类型的体外模型。
本研究中,研究人员开发了新的胃内分泌细胞分化方法,结合此前的研究为整个胃肠道EECs生成了更深度的转录组数据集,并创建了受体突变体生物库用以功能筛选,最终得到了调控GLP-1等激素释放的多种GPCR和通道蛋白,可作为开发口服肠促胰岛素等疗法的研究基础。
总之,本文提出的胃肠道类器官EEC可作为体外功能研究平台,对未来EECs的功能探索和药物开发具有重要意义。
近岸蛋白具备多种经类器官培养验证的细胞因子,让您的类器官培养更可控!
参考资料
1. Worthington, J J et al. “Enteroendocrine cells-sensory sentinels of the intestinal environment and orchestrators of mucosal immunity.” Mucosal immunology vol. 11,1 (2018): 3-20. doi:10.1038/mi.2017.73
2. Beumer, Joep et al. “High-Resolution mRNA and Secretome Atlas of Human Enteroendocrine Cells.” Cell vol. 181,6 (2020): 1291-1306.e19. doi:10.1016/j.cell.2020.04.036
3. Beumer, Joep et al. “Description and functional validation of human enteroendocrine cell sensors.” Science (New York, N.Y.) vol. 386,6719 (2024): 341-348. doi:10.1126/science.adl1460
