关于HGF
肝细胞生长因子(HGF),是一类由间充质细胞分泌的糖基化异源二聚体,由二硫键连接的α链(约57 kDa)和β链(约26 kDa)组成[1],常以非活性形式存在于多种细胞外基质中[2]。作为c-MET的单独配体,HGF作用于各种上皮细胞,以旁分泌方式结合并激活下游Ras-MAPK、PI3K-AKT、STAT、β-链整联蛋白和GAB 1等信号分子介导的各种信号传导通路,从而调节细胞生长、增殖、迁移、存活、运动和形态变化、分化等各种过程[1]。
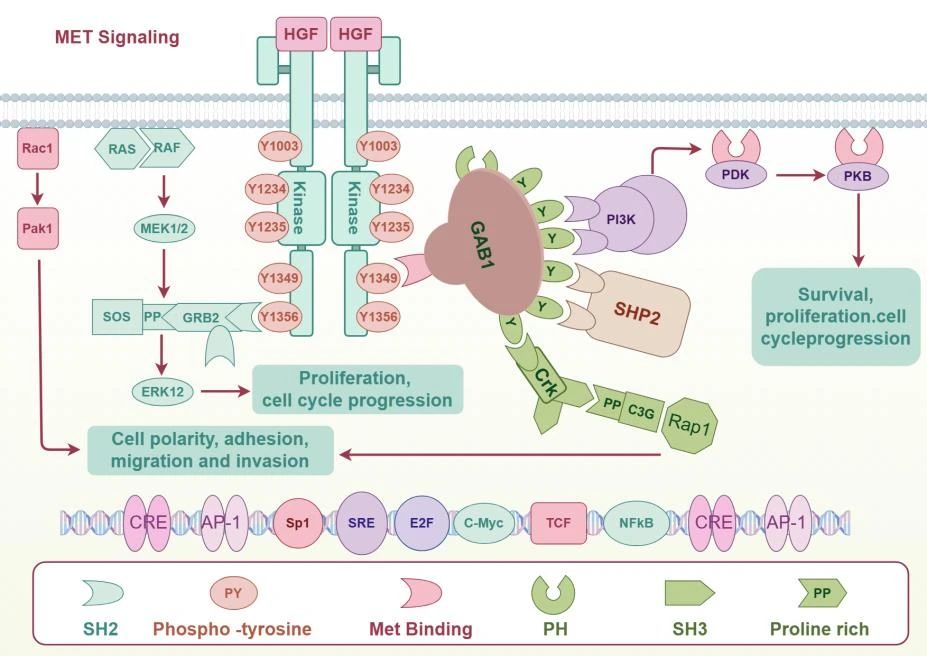 图1.HGF/c-MET信号通路[1]
图1.HGF/c-MET信号通路[1]
成人体内,HGF/c-MET信号通路在恶性肿瘤以外通常不表达活性[3]。不过在肝再生过程中,HGF至关重要。譬如,脂肪性肝病中,具有再生潜力的中性粒细胞和巨噬细胞会被募集,而后以SphK1/S1PR2信号通路释放HGF辅助肝脏再生[4]。除此以外,HGF/c-MET通路还参与肠干细胞生长成微肠的过程。而失调的HGF信号会作为肿瘤微环境中的关键肿瘤促进因子致癌[5]。
总而言之,HGF/c-MET途径在干细胞适应性、生长和维持以及干细胞衍生的上皮组织扩张中起支持作用,因此HGF常常被用作类器官体外培养的生长因子。
HGF与肝脏类器官培养
2018年的一篇文献指出,地塞米松(Dexamethasone)、HGF和EGF的组合添加在肝脏类器官培养中起到了关键的作用。这种组合不仅促进了肝细胞和胆管谱系的分离,还诱使胆管上皮在类器官培养物表面生成[6]。其中,HGF作为关键的生长因子,在促进肝细胞再生和启动肝再生过程中发挥了至关重要的作用。
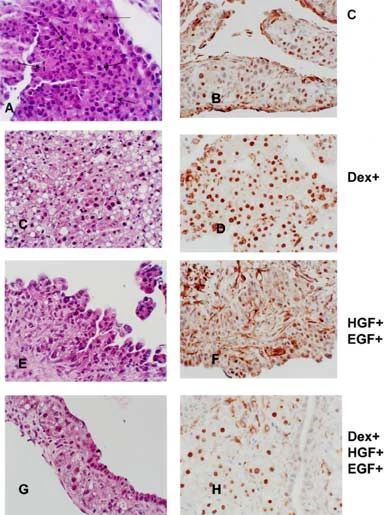
图2.地塞米松、HGF和EGF不同组合,类器官培养物的组织学染色结果[6]
2022年12月,为进一步提高肝类器官的培养效率和质量,东京大学的研究团队对hiPSC来源的肝类器官培养基进行了深入研究和优化[7]。该团队确定了肝类器官各分化阶段所必须的四种生长因子,包括Activin A、BMP4、OSM和HGF。研究发现,HGF对温度诱导的降解高度敏感,这可能导致其在培养过程中的活性降低,因此需要额外加入胎牛血清增强稳定性。此外,HGF需要为大量细胞的高密度分化提供足量信号,因此其浓度也是类器官培养效果的重要影响因子,需要通过精确调控HGF的浓度来满足肝类器官分化的需求。

图3:hiPSC衍生的肝类器官(HLO)的形态[7]
非酒精性脂肪性肝病(NAFLD)是全球最常见的慢性肝病之一,其进展形式非酒精性脂肪性肝炎(NASH)可能导致肝硬化和肝癌。尽管已进行许多研究,但NAFLD/NASH的潜在机制仍不完全清楚,且缺乏有效的治疗方法。2023年9月,发表于Nature Medicine的一则研究深入探究了NAFLD的遗传风险和女性性别之间的相互作用[8]。研究团队将从手术获得的肝祖细胞进行体外培养,通过添加重组人肝细胞生长因子(HGF)等细胞因子,成功衍生出肝脏类器官(HLOs),这一模型为探究NAFLD的发病机制提供了有力的工具。研究发现,雌激素驱动的ER-α与下游配体的结合可促进高遗传风险变体PNPLA 3 p.I148M在肝细胞内脂滴中的合成和蓄积,这一发现揭示了雌激素在NAFLD发病机制中的重要作用。
代谢功能障碍相关脂肪肝病(MASLD)是一类进行性疾病,其肝再生机制已在动物模型内得到了研究,不过囿于伦理和技术限制,相应过程很难在人体器官中复现并得到证明。2024年5月,英国剑桥大学研究团队联合德国、希腊两国科学家在Nature发文[9]。该研究以MASLD患者的终末期肝病样本为出发点,通过添加HGF成功获得肝内胆管细胞类器官,并通过该类器官模型揭示了胆管细胞向肝细胞转分化的一条重要通路。该研究首次在人体样本中证实了胆管细胞向肝细胞转分化的可能性,为MAFLD的肝再生机制提供了新的解释。
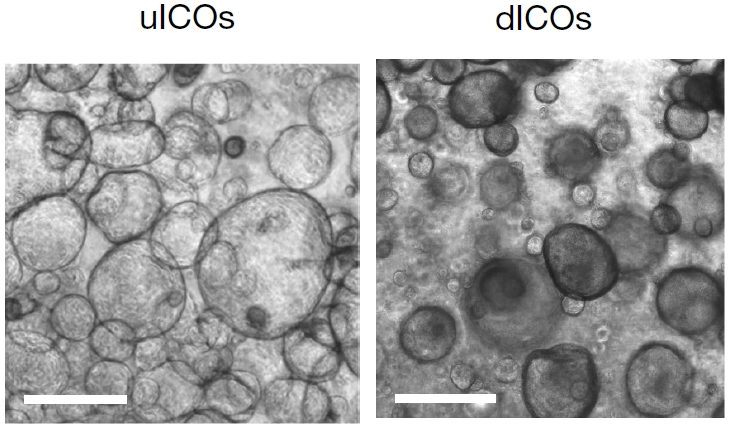
图4:胆管细胞类器官培养基(ulCOs)和分化培养基(dlCOs)中培养的类器官[9]
HGF与胆管类器官培养
胆管癌作为仅次于肝癌的第二大原发性肝脏癌症,其高度侵袭性和较差的预后一直是医学界面临的重大挑战。2023年6月6日,Cancer Communication刊登了一篇研究,通过开发一种新型CAR-T疗法来治疗胆管癌[10]。研究者们将胆管癌患者手术切除的新鲜肿瘤组织通过添加包括人重组HGF、Wnt-3a、FGF-10等在内生长因子的培养基进行体外培养,成功获得胆管癌类器官。该类器官模型被用于体外模拟临床肿瘤的复杂性与持续性。与CAR-T细胞共培养后,胆管癌类器官中心附近出现了较大的凋亡区域,显示出新疗法强大的肿瘤杀伤能力。该研究不仅验证了胆管癌类器官模型在体外模拟临床肿瘤复杂性和持续性方面的有效性,还证明了新型CAR-T疗法在胆管癌治疗中的潜力。
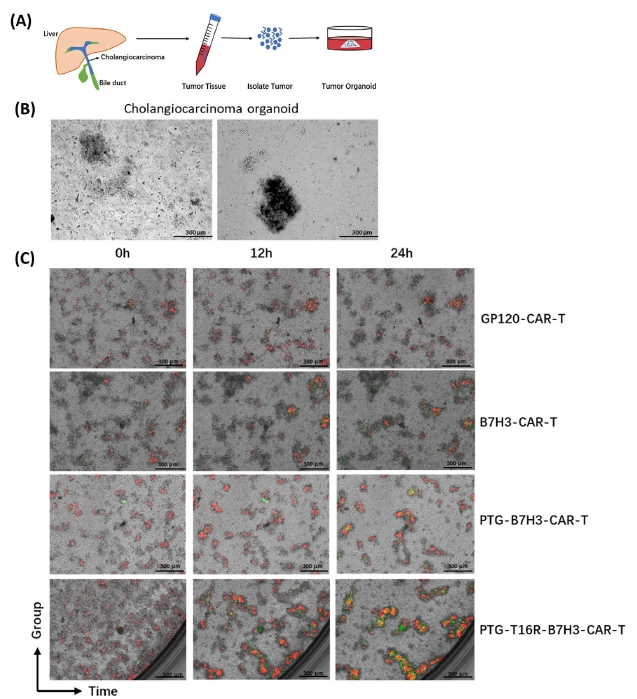
图:a:胆管癌类器官的建立;b:胆管癌类器官显微图像;c:胆管癌类器官与CAR-T细胞共培养的结果[10]
综上,HGF在肝脏类器官培养中起到了至关重要的作用,它是促进肝细胞再生和启动肝再生过程的关键生长因子。近岸蛋白提供高活性,高批间一致性的重组HGF蛋白,并已在类器官平台验证其促进类器官生长的功能,让您的类器官培养更可控!
推荐产品 Recombinant Human HGF (C-6His)(Cat#CJ72)
01 高活性
 Measured by its ability to induce IL-11 secretion by Saos‑2 human osteosarcoma cells. The ED50 for this effect is 0.3-1.5 ng/ml.
Measured by its ability to induce IL-11 secretion by Saos‑2 human osteosarcoma cells. The ED50 for this effect is 0.3-1.5 ng/ml.
02 高批间一致性
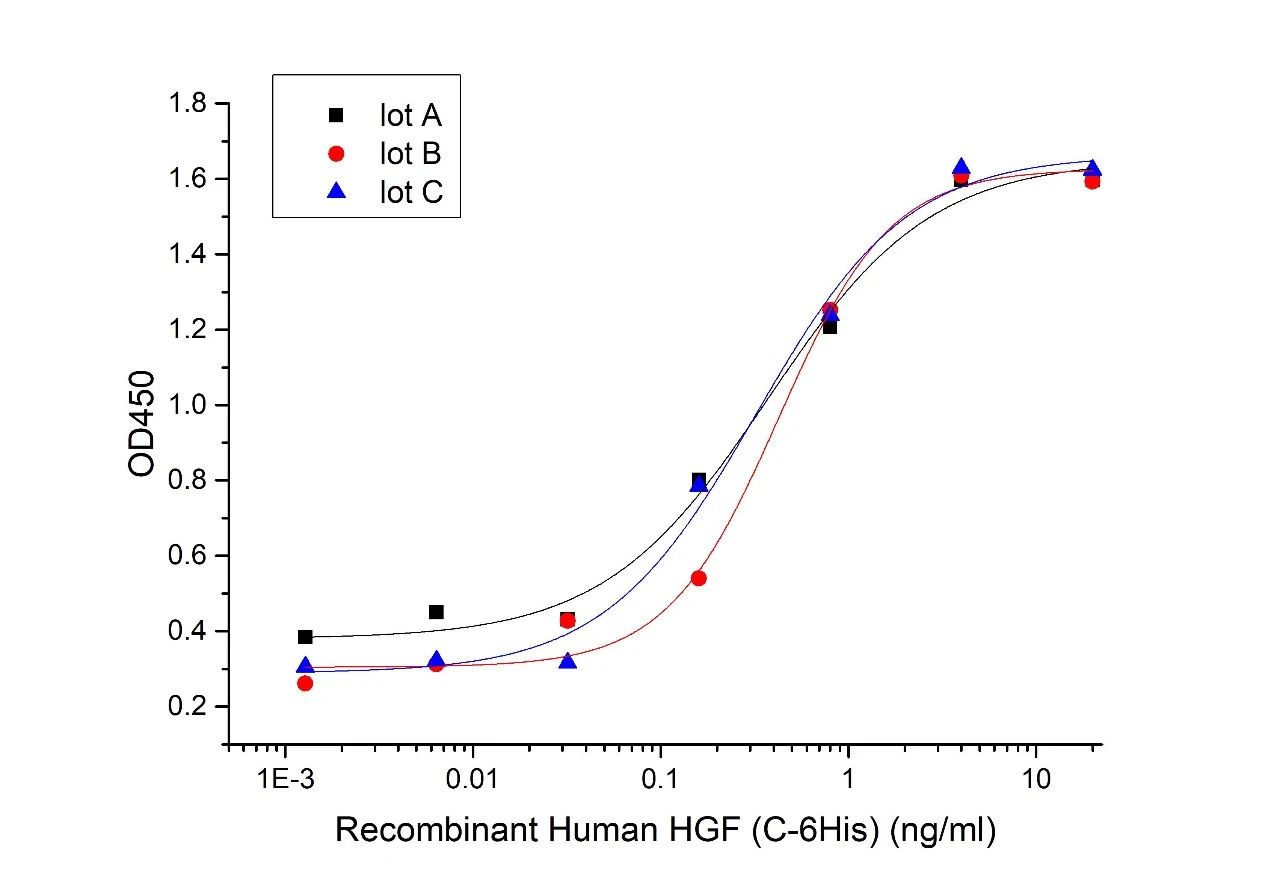 Three independent lots were tested for activity and plotted on the same graph to show lot-to-lot consistency of HGF (Cat#CJ72)
Three independent lots were tested for activity and plotted on the same graph to show lot-to-lot consistency of HGF (Cat#CJ72)
03 类器官验证数据
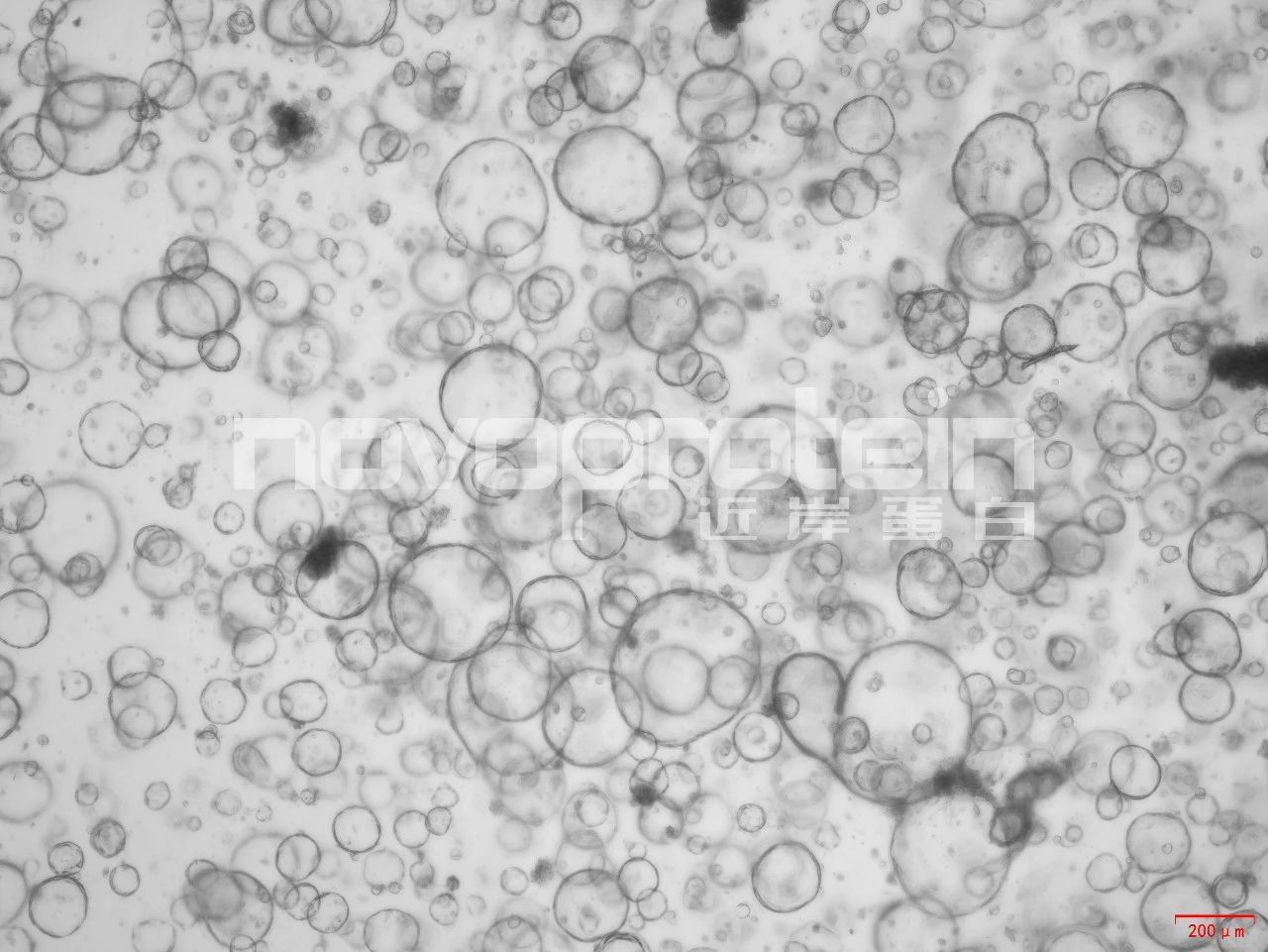
Mouse bile duct organoids were cultured with EGF (Cat#C029) , R-spondin 1 (Cat#CX83) ,FGF-10 (Cat#CR11) and HGF (Cat#CJ72). The organoids showed good morphology.
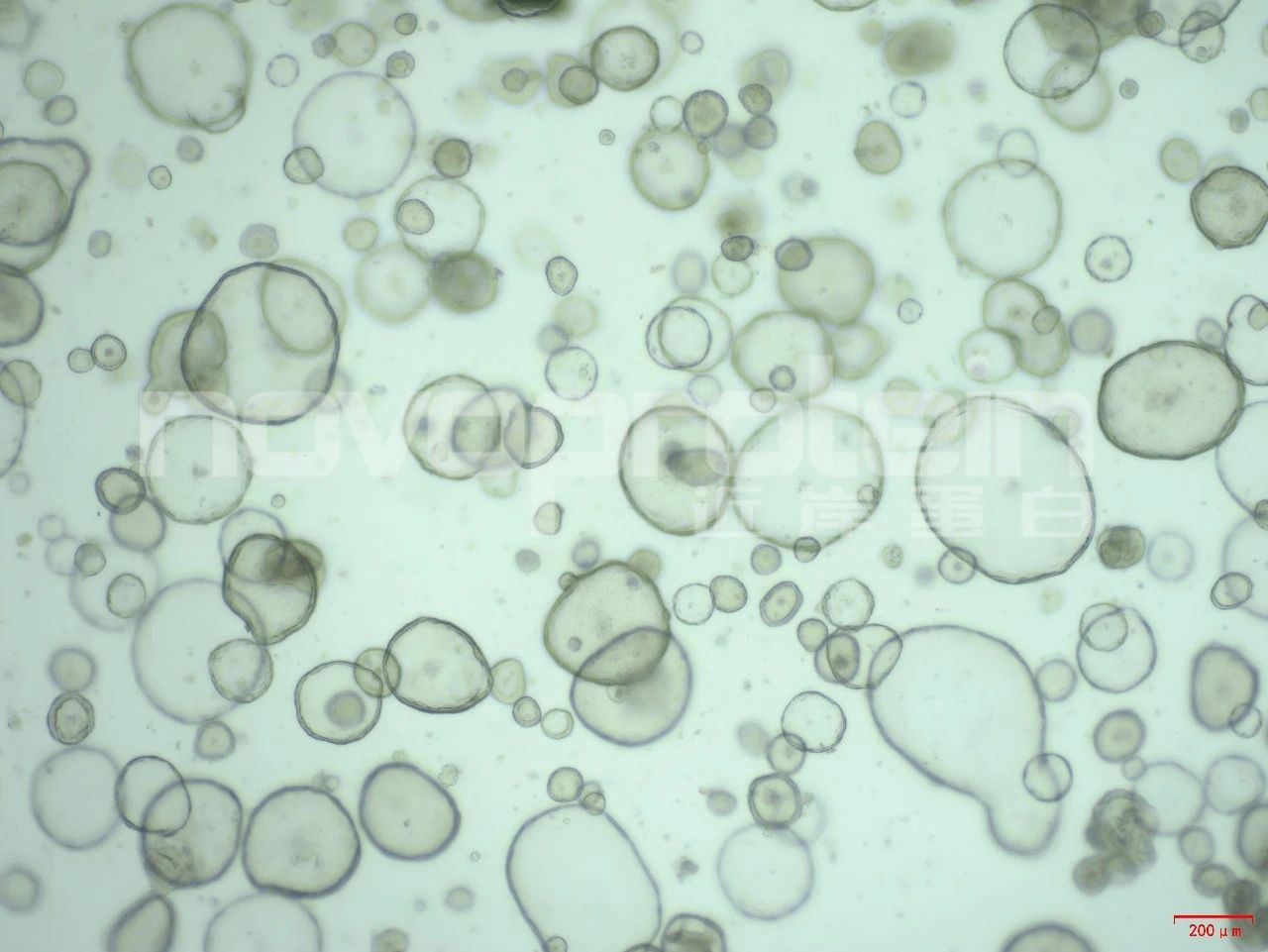
Mouse endometrium organoids were cultured with EGF (Cat#C029) , R-spondin 1 (Cat#CX83) ,Noggin(Cat#C028),Wnt 3a(Cat#C22R),FGF-10 (Cat#CR11) and HGF (Cat#CJ72). The organoids showed good morphology.
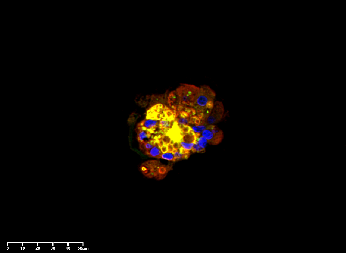
Human hepatocyte organoids (ipsc -derived) were cultured with Activin A(Cat#C687) , FGFb(Cat#C046),BMP-4(Cat#CR93) , EGF (Cat#C029) , Wnt3a (Cat#C22R), OSM(Cat#C099), R-spondin 1 (Cat#CX83) and HGF (Cat#CJ72) . DAPI (blue), ALB(red) and AFP(green).
参考文献
[1] Yao, Shuxi et al. “Unveiling the Role of HGF/c-Met Signaling in Non-Small Cell Lung Cancer Tumor Microenvironment.” International journal of molecular sciences vol. 25,16 9101. 22 Aug. 2024, doi:10.3390/ijms25169101
[2] Zhao, Yang et al. “HGF/c-Met: A Key Promoter in Liver Regeneration.” Frontiers in pharmacology vol. 13 808855. 17 Mar. 2022, doi:10.3389/fphar.2022.808855
[3] Sharma, Rishav, and Rishabha Malviya. “Correlation between hypoxia and HGF/c-MET expression in the management of pancreatic cancer.” Biochimica et biophysica acta. Reviews on cancer vol. 1878,3 (2023): 188869. doi:10.1016/j.bbcan.2023.188869
[4] Lkham-Erdene, Baljinnyam et al. “Effect of Hepatic Lipid Overload on Accelerated Hepatocyte Proliferation Promoted by HGF Expression via the SphK1/S1PR2 Pathway in MCD-diet Mouse Partial Hepatectomy.” Acta histochemica et cytochemica vol. 57,5 (2024): 175-188. doi:10.1267/ahc.24-00046
[5] Soto-Gamez, A et al. “Mesenchymal stem cell-derived HGF attenuates radiation-induced senescence in salivary glands via compensatory proliferation.” Radiotherapy and oncology : journal of the European Society for Therapeutic Radiology and Oncology vol. 190 (2024): 109984. doi:10.1016/j.radonc.2023.109984
[6] Michalopoulos, George K et al. “HGF-, EGF-, and dexamethasone-induced gene expression patterns during formation of tissue in hepatic organoid cultures.” Gene expression vol. 11,2 (2003): 55-75. doi:10.3727/000000003108748964
[7] Torizal, Fuad Gandhi et al. “Dialysis based-culture medium conditioning improved the generation of human induced pluripotent stem cell derived-liver organoid in a high cell density.” Scientific reports vol. 12,1 20774. 1 Dec. 2022, doi:10.1038/s41598-022-25325-9
[8] Cherubini, Alessandro et al. “Interaction between estrogen receptor-α and PNPLA3 p.I148M variant drives fatty liver disease susceptibility in women.” Nature medicine vol. 29,10 (2023): 2643-2655. doi:10.1038/s41591-023-02553-8
[9] Gribben, Christopher et al. “Acquisition of epithelial plasticity in human chronic liver disease.” Nature vol. 630,8015 (2024): 166-173. doi:10.1038/s41586-024-07465-2
[10] Qiao, Yidan et al. “Enhancement of CAR-T cell activity against cholangiocarcinoma by simultaneous knockdown of six inhibitory membrane proteins.” Cancer communications (London, England) vol. 43,7 (2023): 788-807. doi:10.1002/cac2.12452
